[PR]当サイトはアフィリエイト広告を利用しています。
はじめに
今回の記事の一部を動画にまとめました。
よろしければそちらもご覧ください。
今回は硝酸イオンとpHの関係について。
アクアリウムをやっていると
「しばらく経った水槽はpHが低下する。これは水中の硝酸が増えるから」
という説明を結構目にします。
これは化学的にどういう作用なのか気になったので調べてみました。
結論から言うと、硝酸イオンが増えるからpHが下がるというよりは次のような説明が適切のようです。
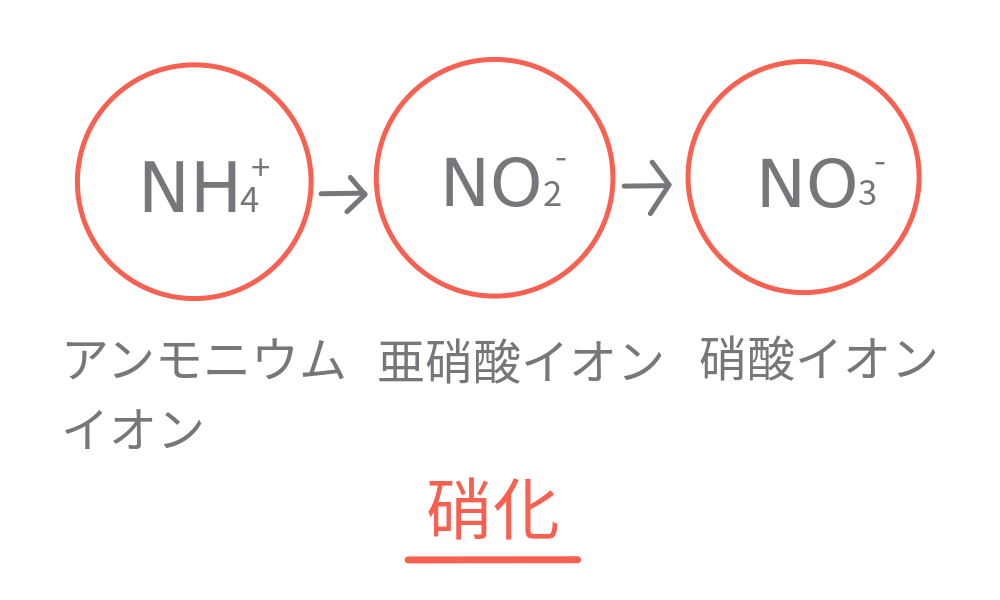
硝酸イオンの原料となるアンモニウムイオンが亜硝酸菌によって亜硝酸イオンになるときに、H+を放出するためにpHが下がる。
亜硝酸イオンが硝酸菌によって硝酸イオンになる過程ではH+は発生せず、硝酸イオンが発生したからpHが増えるというわけではない。
ただし亜硝酸イオンは硝酸イオンに分解されていくから、結果として硝酸イオンが増えるとアンモニウムイオンも分解されたことになり、pHが下がる。
また酸性雨の話では
「硝酸イオンが多いとpHが低い」
とあります。

この話から硝酸イオンの増加はpHの低下をもたらす、と考えることもできますが、これも次のような話で説明できます。
硝酸イオンの発生源は大気中の二酸化窒素で、これが硝酸に変化し、それが雨水に溶け込むことでpHが下がる。溶け込むときにできるのが硝酸イオンである。
つまり硝酸イオンが単純に増えたからpHが下がるというよりは、元の硝酸が溶けるときにH+を放出するからpHが下がる。
今回の記事ではこの話を掘り下げていきます。
アクアリウムの硝酸イオン
アクアリウムの生物ろ過では
「硝化」
を行っています。
これは生物の遺骸などがアンモニウムイオンに分解され、それが亜硝酸イオン、硝酸イオンに変化していくことです。
硝化についてまとめました。よろしければご覧ください。
「>バクテリアをめぐる話〜ろ材の基本的な考え方+アンモニアの計算」
これは亜硝酸菌と硝酸菌の作用で、その化学反応は次のように表されます。
亜硝酸菌の反応は
2NH4++3O2→2NO2–+4H++2H2O+化学エネルギー
硝酸菌の反応は
2NO2–+O2→2NO3–+化学エネルギー
このように酸素を使ってエネルギーが発生します。
亜硝酸菌の反応のときだけH+が発生しています。
pHは水溶液中のH+の濃度の指標なので、H+が増えればpHは下がります。
つまり亜硝酸菌の反応でpHが下がります。
この考察は次の文献(1)を参考にしました。
茶園でアンモニウムイオンが硝酸イオンに硝化する際のpHについて扱っています。
(1)参考:早津雅仁 小菅伸郎、「硝酸化成が茶園土壌のpHに及ぼす影響」、野菜・茶業試験場研究報告. B (金谷) 3:1〜8 (1989).
また硝酸菌の反応式から亜硝酸イオンが硝酸イオンに分解される過程ではH+は変化しないため、亜硝酸イオンの分解ではpHは変化しません。
ただしアンモニウムイオンから亜硝酸イオン、硝酸イオンへと変化する過程は連続的に行われるため、アンモニウムイオンが分解されるとそれは最終的に硝酸イオンになります。
つまり硝酸イオンが増えると、アンモニウムイオンが分解されたと考えられるため、硝酸イオンが増えるとpHが下がると結果的に言える、ということになります。
アンモニウムイオンが分解されればpHが下がるので。
でも酸性雨の話では硝酸イオンが多いとpHが低いと言っているけど?
酸性雨の研究では
「硝酸イオンが多いとpHが低い」
というものがあります(2)。
(2)参考:玉 置 元 期 ・平 木 隆 年、「神戸地域におけ る雨水中の硝酸イオ ンと亜硝 酸イオンの挙動」、日 本 化 学 会 誌,1980,(7),P・1169~1177.
じゃあやっぱり硝酸イオンが増えるだけでpHが下がるのではないか、と考えたくなりますが、これも次の文献の化学反応から説明が付きます(3)。
気相反応では OH が NO2を直接酸化し,硝酸が生成する。これは光化学反応で OH が生成する昼間に起こる反応である。
NO2+OH→HNO3(7)
また,昼間生成したオゾンが夜間にも残っているとき,NO2とこのオゾンが反応し NO3ラジカルを生成する。このラジカルと NO2とは五酸化二窒素(N2O5)と化学平衡にある。この N2O5は水と反応して硝酸になる。このように硝酸は夜間にも生成する。昼間は NO3ラジカルが生成しても,NO3+hν→NO2+O という光化学分解を受けるので,このメカニズムによる硝酸の生成はない。
NO2+O3 → NO3 + O2 (8)
NO3 + NO2⇄N2O5 (9)
N2O5 + H2O → 2HNO3 (10)
(3)参考:原 宏、「酸性雨とフィールドサイエンス(Ⅰ)――湿性沈着の現状と科学としての発展――」、フィールドサイエンス(J. Field Science)1:1―13,2002.
二酸化窒素は産業活動の排気ガス、特に自動車の排ガスから発生します。

これが大気中で硝酸に変化し、硝酸は水に溶ける強酸の物質です。
雨水に溶けた硝酸は溶けるときにH+を放出するのでpHが下がります。
そして雨水中の硝酸イオンとpHの関係を述べるときの硝酸イオンは、この大気中にできた硝酸が水に溶けたときの硝酸イオンと考えられます。
つまり硝酸イオンが増えるからpHが下がるというよりは、硝酸が溶けると硝酸イオンが発生するので、硝酸イオンの量を測れば、それだけ硝酸が溶けたと考えることができ、結果的に硝酸イオンの量が増えるとpHが下がると言える、ということのようです。
硝酸と硝酸イオンの違い
次の文献(4)によると
H2SO4は酸であるが,SO42-は酸ではない。先に「酸はH+を出す化合物である」といった,つまり化合物の中の水素原子のまわりにある電子がうんと引っぱられていて,この水素原子がH+として出やすくなっているのが酸である。
(4)参考:原 宏、「酸性雨―第1講「酸性雨」とpH―」、大気汚染学会誌 第26巻 第1号(1991)
つまりこれを硝酸に適用すると
「HNO3は酸であるが、NO3–は酸ではない」
と言えます。
つまり硝酸と硝酸イオンは区別するべきものであり、ここを混同しないことが大切です。
アクアリウムで
「硝酸が増えてpHが…」
と言えば、硝酸イオンの話をしていると考えたほうがいいでしょう。
生物ろ過で発生するのは硝酸ではなく、硝酸イオンですからね。
そして硝酸イオンそのものにはH+を出す効果がないので、これが増えるからpHが下がるというわけではないのです。
まとめ
今回は硝酸イオンとpHについてその関係を化学の視点から考えてみました。
結局硝酸イオンが増えるとpHが下がった状態なので、水換えは大事という話ですね。